技术交流navigation

电话:021-35183767
传真:021-35183767-8008
qq:2881513766
地址:上海市闵行区兴梅路485号 xingmei rd 485shanghaichina
文献速递 | if=15.1玉研肺部雾化给药装置助力弹性蛋白酶纳米复合物消灭肺癌细胞
时间:2024-05-22来源:本站作者:玉研仪器
文献速递 | if=15.1玉研肺部雾化给药装置助力弹性蛋白酶纳米复合物消灭肺癌细胞
肺癌是当异常细胞在肺部以不受控制的方式生长时开始的一种癌症。它是一个严重的健康问题,可以导致严重的伤害和死亡,是全世界癌症相关死亡的主要原因,在男性和女性中的死亡率均为最高。目前,靶向治疗是一种以干扰癌变或肿瘤增生所需的特定分子来阻止癌细胞增长的一种药物疗法,对于肿瘤中发现特定基因突变或生物标志物的患者来说,是一种重要的选择。
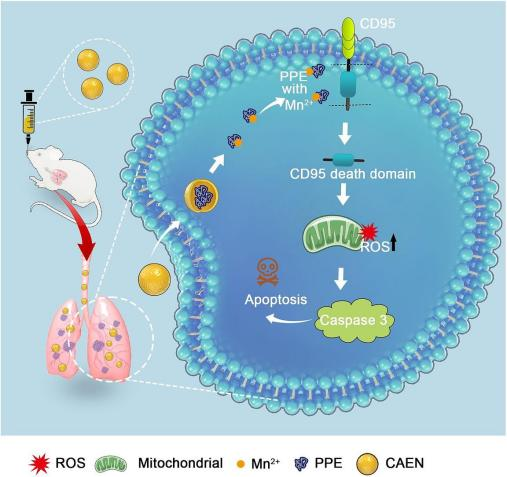
最近,北京大学基础医学院林志强团队在国际知名期刊chemical engineering journal(if=15.1)发表一篇题为“an elastase nanocomplex with metal cofactors for enhancement of target protein cleavage activity and synergistic antitumor effect”的文章。该研究借鉴金属离子调节蛋白质功能和活性的方式,采用基于金属辅因子的方法,以胰腺弹性蛋白酶(ppe,elane 同系物)为模型药物,增强靶蛋白裂解和抗肿瘤效应。作者体外开发并优化了一种具有增强裂解活性的弹性蛋白酶纳米复合物(caen),借助玉研肺部雾化给药装置定量靶向给予到小鼠肺部,caen阻止了ppe在生物环境中的降解,并有效地将其传递给肿瘤细胞。通过有效裂解跨膜蛋白cd95(与游离ppe相比具有更高的特异性),caen在肺癌细胞中诱导了显著的凋亡。

caen能够保护和稳定ppe蛋白的活性
caen主要通过无创雾化吸入进入肺组织,实现肺组织特异性蛋白药物传递(图1)。在肿瘤细胞中,从caen释放的ppe与mn2 嵌合体特异性裂解肿瘤细胞的跨膜蛋白cd95,导致细胞凋亡,而且释放的mn2 能有效增强肺部肿瘤组织的局部免疫反应。
图 1 弹性蛋白酶纳米复合物(caen)
由于血液中存在多种丝氨酸蛋白酶,因此在实际应用中可能会抑制ppe的活性。作者为了验证caen对血清的敏感性,在不同细胞系中使用了含或不含胎牛血清的培养基进行细胞毒性试验。结果如图2所示。caen组在使用含或不含血清培养基进行实验时,均表现出显著的细胞毒性作用。
图 2 不同制剂(含或不含血清)处理后的细胞存活率
上述实验表明设计的caen能够稳定ppe的活性,防止其受到血清中蛋白酶抑制剂的抑制,达到完全的抗肿瘤效果。这充分说明金属离子的矿化改性策略有望提供一种保护ppe活性的方法,caen的生物矿化作用为这类功能蛋白在抗肿瘤治疗中的有效活性提供了纳米屏障。
caen可特异性裂解cd95促进肿瘤细胞凋亡
为了验证不同制剂组裂解cd95的能力,作者纯化了mbp-cd95蛋白并进行切割实验。首先,将不同制备组与mbp-cd95蛋白孵育30min,结果见图3两组之间的差异在于ppe组完全裂解wbp-cd95,而caen组仅选择性裂解cd95蛋白。因此,弹性蛋白酶与锰离子的生物矿化复合物可以实现cd95 蛋白的特异性裂解。

图 3 不同制剂与mbp-cd95体外切割效果验证
作者在b16-f10肿瘤细胞上进行了细胞凋亡实验。流式细胞术结果显示,caen治疗组发生凋亡的肿瘤细胞比例最显著,表明caen具有诱导细胞凋亡的能力。
图 4 不同制剂凋亡实验细胞仪数据分析
上述实验强调了caen裂解靶蛋白的潜力及其抗肿瘤作用。
caen可提高药物的输送效率和肺部滞留时间
研究表明,与静脉给药相比,吸入和递送治疗药剂可对局部恶性肿瘤组织实现更好的治疗效果,并降低不相关的全身效应的可能性。在文章中,作者使用玉研仪器公司的肺部雾化给药装置(yan-30012)对小鼠肺部定量输送caen制剂。
为了验证雾化装置能够成功给药,作者使用考马斯亮蓝溶液(cbb)作为指示剂来证明药物可以有效地进入小鼠的肺组织。图6可以观察到小鼠肺组织中有明显量的cbb液,主要均匀分布在气管、支气管。因此,肺部雾化给药有望有效实现纳米粒子的局部递送和组织器官的特异性治疗。
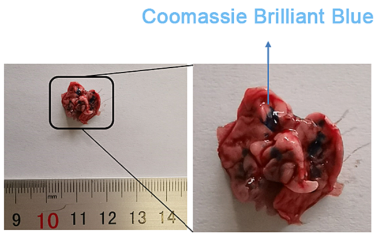
图 5 考马斯亮蓝溶液已被雾化吸入
为了检验caen在肺部的滞留,作者使用cy7荧光染料标记的ppe和caen进行肺部雾化给药,并取出肺组织用于荧光成像观察。实验结果表明,采用肺部雾化给药方法可使caen均匀进入肺组织。
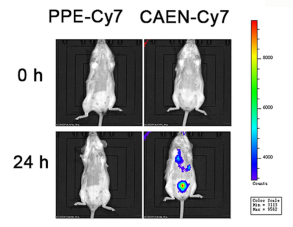
图 6 小鼠雾化吸入ppe和caen后不同时间点的荧光成像结果
此外,作者还评估了肺部雾化给药后不同制剂在肺组织中的跨粘膜吸收行为。吸入ppe-cy7和caen-cy7后24小时,处死小鼠,采集肺进行荧光成像。荧光成像如图所示,在用caen-cy7处理的肺中观察到更强和更深的荧光分布,表明矿化纳米颗粒作为载体表现出优异的渗透和保留能力,能够显著改善生物大分子蛋白的跨粘膜通透性和截留率。
图 7 各组离体器官和肺组织切片荧光成像结果
上述实验结果表明,与游离蛋白相比,caen能提高细胞摄取效率,并延长蛋白在局部组织中的保留时问。
体内递送caen可抑制肿瘤生长
为验证caen的抗肿瘤作用,c57bl/6小鼠经尾静脉注射b16-f10细胞,形成肺癌模型。在第5、9、13、17天使用玉研肺部雾化给药装置给小鼠肺部给药,进行局部抗肿瘤治疗。在第5、13和21天,解剖小鼠并收集其肺组织。随后,作者计数了小鼠肺组织中的转移灶(图10)。caen组在抗肿瘤治疗期间保持了优异的治疗效果,无明显转移。ppe组出现了明显的转移灶,这可能是由于ppe气雾剂吸入无法有效进入肿瘤细胞,使肺组织表面的弹性纤维降解,促进了肿瘤细胞的转移。
肿瘤组织h&e染色显示(图11),caen给药组小鼠组织切片中癌细胞较少,而pbs组和ppe组中癌细胞较多。

图 8 小鼠肺部给药示意图
图 9 使用pbs、ppe和caen治疗的小鼠肺组织图像和肺转移结节数量
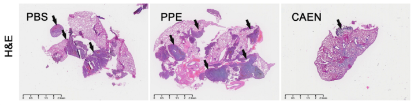
图 10 肺组织转移灶的h&e染色组织学检查
健康小鼠经同样处理后(图12),发现 ppe处理组对健康小鼠肺组织造成炎性损伤,caen处理组和pbs处理组无明显变化。ppe蛋白对肺组织的损伤有利于肿瘤的扩散和转移,这也解释了ppe治疗组小鼠在第21天出现严重肿瘤病变的原因。
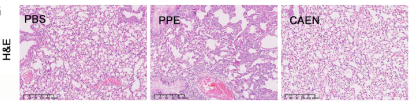
图 11 未接种肿瘤的小鼠经同样处理后肺组织的h&e染色结果
tunel染色(图13)证实caen有效诱导细胞凋亡,其中caen组cd8t细胞比例最高,提示其在肺肿瘤组织中有高度浸润,有利于杀伤肿瘤细胞。

图 12 各组小鼠肺组织tunel和cd8 t细胞染色结果
caen可以通过肺部雾化给药实现器官特异性递送,扩大了ppe蛋白的应用范围。在动物实验中,caen在锰离子的辅助下,可显著诱导肿瘤细胞凋亡,激活肿瘤组织的局部免疫反应。
结论
猪胰腺弹性蛋白酶(ppe)作为一种新型的抗肿瘤蛋白药物,具有很强的诱导肿瘤细胞凋亡的能力。然而,由于其固有的缺陷,ppe在肿瘤治疗中的应用受到限制,在本研究中,作者设计并制备了一种切割活性增强的弹性蛋白酶纳米复合体(caen),该复合体含有ca2 、ppe及其辅因子(mn2 )以实现cd95 蛋白的特异性切割。caen不仅有效地保护和稳定了ppe蛋白的活性,而且在不同类型的癌细胞中也表现出有效的杀伤作用。通过玉研肺部雾化给药装置,有效实现了纳米粒子caen在小鼠肺部的定量精准靶向递送和肺部组织器官的特异性治疗效果。caen中金属离子的释放影响了肺部肿瘤细胞的内环境,导致肿瘤细胞内活性氧水平升高和线粒体损伤。结合mn2的免疫激活功能,caen在体内外均能有效抑制肿瘤细胞的生长,具有良好的生物安全性。总之,该研究为蛋白质药物在抗肿瘤治疗中的应用提供了有效的研究思路。
产品简介
玉研仪器肺部雾化给药装置(microsprayer aerosolizer)也称作气管内雾化给药装置,是专门为小鼠、大鼠、豚鼠等小动物设计,可精确进行气管内雾化给药的装置。可将定量液体通过集成在不锈钢毛细插管中的气溶胶雾化微喷头雾化,毛细插管可深入动物至支气管分叉处,实现气管内定量雾化成气溶胶给药。相较于传统口服或注射给药,药物可直接作用于肺部,适用于肺部生理、病理、药理学研究,按给药的状态不同还可分为液体给药以及干粉给药。
产品特点
l 适用于小鼠、大鼠、豚鼠、兔子等小动物,也可走制大动物专用款;
l 气管内直接给药,无首关消除,药物全身效应小
l 药物可为液体或干粉,满足不同需求
l 微量精确给药,最小药物用量25ul(液体)
l 可用于溶液、小细胞悬浮液、均质悬浊液、粘度较低的乳浊液、干粉等给药
l 90%药物雾化直径<30um(液体),可均分布于大小肺部组织中
l 使用方便,安全稳定,采用不锈钢材质,坚固稳走耐腐蚀
l 可用于吸入毒理学、空气生物学、生物危害测试、吸入免疫、吸入治疗、药物研究、环境评价、危害评估和医学防护等诸多领域
玉研仪器肺部雾化给药装置可提供中化所专业粒径分布测试报告,从报告中可以看到90%药物雾化直径<30um(液体)。
雾化效果展示(gif)
肺部雾化给药的优势
1. 可直接将药物定量递送至肺部或以肺部为媒介。实现局部或系统疾病的治疗
2. 肺部给药可以避免肝首过效应,降低给药剂量,减少不良反应
3. 肺部给药可以快速吸收药物进入体循环,保持药物的生物活性,适用于蛋白质多肽的给药
4. 肺部给药是一种新型的、更有效的促进药物肺内均匀分布的给药方法,只需单次雾化,且剂量能准确控制
玉研肺部给药装置通堵装置
通堵装置是一种玉研仪器最新设计,用于清除肺部给药装置针头管道内的堵塞物,和保证肺部给药装置内管道畅通的工具。
l 主要功能:通堵器的设计目的是清除肺部给药装置针头管道内的堵塞物,如药液残留、黏附的微粒或其他杂质。确保药物能够顺利到达肺部,达到预期的治疗效果。
l 预防堵塞:除了清除已有的堵塞,通堵器还可以用于日常维护,定期使用可以防止药液残留在管道内凝固,预防未来的堵塞问题。
l 易于使用:通堵器设计为手持工具,操作简便,用户可以方便地使用它进行日常的设备维护,不需要复杂的操作。
l 清洁方便:采用高性能pek(聚醚酮)材质,可以使用常见的高温高压蒸汽灭菌或者酒精消毒,使其易于清洁和消毒,确保在使用过程中不会引入新的污染物。
拓展阅读
1.li, cheng et al. “broad neutralization of sars-cov-2 variants by an inhalable bispecific single-domain antibody.” cell vol. 185,8 (2022): 1389-1401.e18. doi:10.1016/j.cell.2022.03.009
2.peng, boya et al. “robust delivery of rig-i agonists using extracellular vesicles for anti-cancer immunotherapy.” journal of extracellular vesicles vol. 11,4 (2022): e12187. doi:10.1002/jev2.12187
3.yue, dayong et al. “diesel exhaust pm2.5 greatly deteriorates fibrosis process in pre-existing pulmonary fibrosis via ferroptosis.” environment international vol. 171 (2023): 107706. doi:10.1016/j.envint.2022.107706
4.zhang, mengjun et al. “airway epithelial cell-specific delivery of lipid nanoparticles loading sirna for asthma treatment.” journal of controlled release : official journal of the controlled release society vol. 352 (2022): 422-437. doi:10.1016/j.jconrel.2022.10.020
5.gu, peiyu et al. “protective function of interleukin-22 in pulmonary fibrosis.” clinical and translational medicine vol. 11,8 (2021): e509. doi:10.1002/ctm2.509
6.wu, lan et al. “poly(lactide-co-glycolide) nanoparticles mediate sustained gene silencing and improved biocompatibility of sirna delivery systems in mouse lungs after pulmonary administration.” acs applied materials & interfaces vol. 13,3 (2021): 3722-3737. doi:10.1021/acsami.0c21259
7.tian, xidong et al. “pulmonary delivery of reactive oxygen species/glutathione-responsive paclitaxel dimeric nanoparticles improved therapeutic indices against metastatic lung cancer.” acs applied materials & interfaces vol. 13,48 (2021): 56858-56872. doi:10.1021/acsami.1c16351
8.yang, huilin et al. “triptolide dose-dependently improves lps-induced alveolar hypercoagulation and fibrinolysis inhibition through nf-κb inactivation in ards mice.” biomedicine & pharmacotherapy = biomedecine & pharmacotherapie vol. 139 (2021): 111569. doi:10.1016/j.biopha.2021.111569
9.su, ruonan et al. “venetoclax nanomedicine alleviates acute lung injury via increasing neutrophil apoptosis.” biomaterials science vol. 9,13 (2021): 4746-4754. doi:10.1039/d1bm00481f
10.xu, yingying et al. “pegylated ph-responsive peptide-mrna nano self-assemblies enhance the pulmonary delivery efficiency and safety of aerosolized mrna.” drug delivery vol. 30,1 (2023): 2219870. doi:10.1080/10717544.2023.2219870
精彩回顾
关于玉研仪器肺部给药装置的更多应用可阅读下方推文,其主要介绍了复旦大学团队发表于cell杂志上的论文,主要研究了一种新型sars-cov-2 0micron单域抗体通过使用玉研仪器肺部雾化给药装置以雾化吸入途径的输送到小鼠肺部,为新冠的治疗提供了一种新的可能。
中国药科大学药学院姜虎林教授团队构建了一种双药负载纳米颗粒,借助玉研肺部液体定量雾化器,将固定量的纳米颗粒溶液雾化成直径10-30um的气溶胶,并弥漫扩散到小鼠的整个肺部。在治疗两周之后,发现肺纤维化小鼠的肺功能以及肺部组织结构都可喜地恢复了健康。
滨州医学院、中国医学科学院/北京协和医学院天津市生物医学材料重点实验室王伟伟团队联合西安电子科技大学邓宏章团队制备氨基糖苷类抗生素(ags)和鞣酸(ta)的新型纳米颗粒并使用了玉研仪器肺部雾化给药装置进行了肺部定量输送纳米颗粒治愈小鼠铜绿假单胞菌急性肺炎。
